Системный амилоидоз – это заболевание, связанное с накоплением белка с измененной пространственной структурой в межклеточном пространстве. Нерастворимые фибриллы амилоидного белка нарушают архитектуру нормальной ткани, функцию поврежденного органа и, в конечном итоге, вызывают гибель клеток.
Такие структурные изменения могут происходить во множестве циркулирующих белков – фрагментах антител (амилоидоз легкой цепи (AL) или тяжелой цепи (AH) моноклонального антитела), транспортных белках (транстирен, TTR, амилоидоз ATTR, амилоидоз некоторых аполипопротеинов, фазовых белках (сывороточный амилоид A, SAA, амилоидоз AA) и других белках плазмы.
Системный амилоидоз может быть осложнением некоторых заболеваний (пролиферация плазматических клеток (дискразия) – амилоидоз AL и AH, хронические воспалительные заболевания – амилоидоз AA), следствием генетической предрасположенности (TTR и другие формы наследственного амилоидоза) или факторов (В 2 дикого типа при лечении диализом, микроглобулин-ассоциированный амилоидоз, TTR-ассоциированный амилоидоз дикого типа по мере старения организма).
Хотя эти формы амилоидоза различаются по биохимии и происхождению, клинически все они проявляются сходным образом. Преобладающие симптомы зависят от того, на какие органы направлено заболевание. Амилоидоз обычно поражает почки и сердце, реже периферическую / вегетативную нервную систему, печень, желудочно-кишечный тракт и мягкие ткани. При некоторых формах амилоидоза преобладает поражение почек, а амилоидоз, связанный с диализом, обычно поражает костную ткань и связки.
Амилоидоз диагностируется путем обнаружения амилоидного белка в гистологическом препарате ткани, который обычно светится зеленым цветом, особенно в конго красном, после окрашивания исследуемой ткани и освещения ее поляризованным светом.
После определения структуры амилоида важно правильно оценить тип амилоида, отследив белок, из которого образовался патологический амилоид. Точную диагностику заболевания проводят с использованием иммунологических методов диагностики (иммуногистохимия), иммуноэлектронной микроскопии или измерения масс-спектра.
Для постановки точного диагноза заболевания эти методы диагностики дополняются комплексным клиническим, биохимическим и гематологическим обследованием, визуализацией и генетическим тестированием. Помогают идентифицировать белок, из которого образуется амилоид, оценить повреждения органов и реакции заболевания на лечение, использование биомаркеров.
Современные методы лечения амилоидоза направлены на максимальное уменьшение количества белка, продуцирующего амилоид, в организме, нарушение процессов образования амилоида и содействие естественному выведению амилоида из организма.
В последние годы лучшее понимание молекулярных механизмов этого заболевания позволило ученым открыть новые варианты лечения. В этой статье рассматриваются последние варианты лечения амилоидоза и эффективность биомаркеров в лечении пациентов с амилоидозом.
Содержание статьи
AL амилоидоз
Амилоидоз легкой цепи иммуноглобулина (AL) – это наиболее часто диагностируемая форма системного амилоидоза в западных странах, поражающая 10 человек на миллион населения в год. Эта форма заболевания возникает, когда в костном мозге формируется небольшая и медленно пролиферирующая группа плазматических клеток (редко В-клеток). Эти клетки продуцируют нестабильные амилоидогенные легкие цепи иммуноглобулинов.
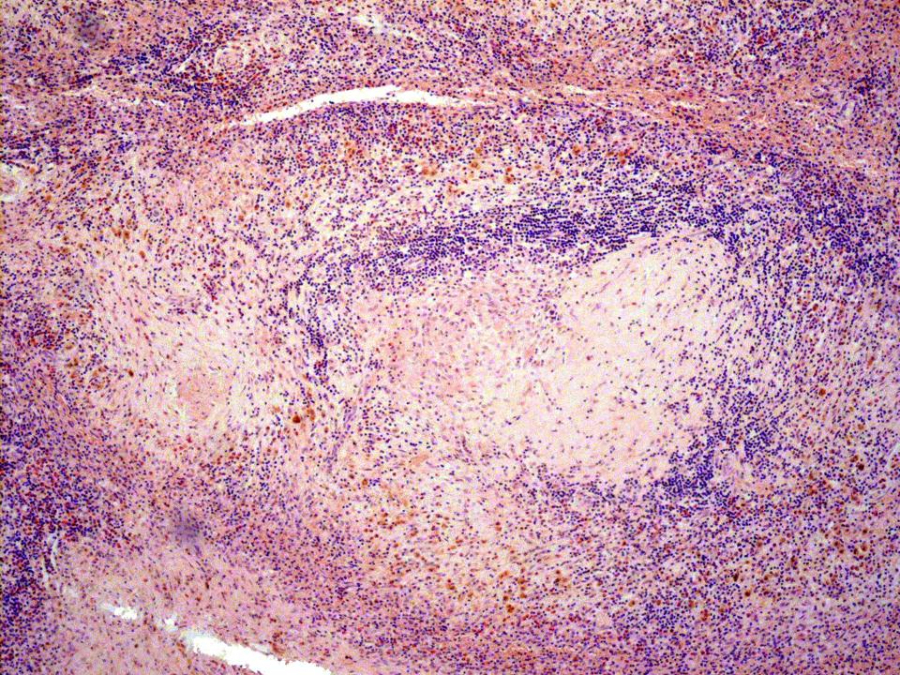
Довольно редко патологический амилоидный белок образуется из моноклональных тяжелых цепей (либо отдельно, либо с моноклональными легкими цепями). Затем у больного развивается амилоидоз AH или AHL соответственно.
Системный амилоидоз AL может поражать практически любой орган, кроме головного мозга, но чаще всего встречаются поражения:
- почек и сердца – около 70% случаев;
- печень – 22%$
- периферическая / вегетативная нервная система – 15%$
- мягкие ткани – 15%.
Наиболее специфическиt (патогномоничныt) признакb амилоидоза AL – макроглоссия и периорбитальная пурпура, но последняя выявляется менее чем в 15% случаев.
Важно отметить, что прогноз заболевания зависит от степени повреждения сердца, поскольку сердечная дисфункция является основной причиной смерти пациентов с амилоидозом AL. Наихудший прогноз – когда амилоидоз поражает миокард и заболевание диагностируется слишком поздно или лечение неэффективно. Амилоидоз AH и AHL чаще всего поражает почки, но значительное повреждение сердца выявляется редко, что приводит к лучшему прогнозу этой формы заболевания.
Роль биологических маркеров в лечении амилоидоза AL
Важность биомаркеров в диагностике амилоидоза AL и в оценке прогноза заболевания и ответа на лечение очень высока. С помощью биомаркеров можно эффективно оценить в сыворотке крови свободные легкие цепи (англ. Free light chain -FLC), активность клона плазматических клеток. Путем анализа уровней натрийуретических пептидов (NT-pro BNP или BNP) в крови и сердечного тропонина (TnI или TnT и тропинин I или T гиперчувствительности) можно определить уровень повреждения сердца. А повреждение почек можно оценить путем оценки уровня протеинурия и скорость клубочковой фильтрации (GFG).
Эти биомаркеры можно использовать для оценки прогноза заболевания и эффективности лечения. Выведение натрийуретических пептидов из организма и, следовательно, их уровень в крови зависит от GFG, поэтому оценку BNP, а не NT-pro BNP следует проводить у пациентов с терминальной стадией почечной недостаточности (ESRD). В настоящее время исследуются несколько новых биомаркеров,
Один из наиболее важных биомаркеров при изучении и лечении пациентов с амилоидозом AL – сывороточный FLC. При его оценке учитываются дискразии плазматических клеток. Этот маркер с сердечным тропонином I или Т и натрийуретическими пептидами является ценным индикатором для определения риска для пациента. На основании этого показателя также оценивается гематологический ответ на лечение.
Если у пациента имеется почечная недостаточность, к значениям FLC следует относиться с осторожностью. Внедрение масс-спектрометрии привело к детальной оценке молекулярной массы и аминокислотной последовательности легких цепей моноколиновых иммуноглобулинов сыворотки крови в этих белках. Масс-спектрометрия, вероятно, со временем внесет значительный вклад в изучение и стратегию лечения пациентов с амилоидозом AL.
Современное лечение амилоидоза AL
Современные стратегии лечения амилоидоза AL основаны на опыте лечения множественной миеломы, но пациенты с амилоидозом AL значительно более уязвимы. Повреждение конкретного органа из-за накопления амилоида ограничивает варианты лечения, поэтому особенно важно изменить стратегию лечения в соответствии с риском пациента и ответом на лечение.
Снижение СЛЦ в сыворотке часто приводит к снижению уровней натрийуретических пептидов и улучшению сердечно-сосудистого статуса у пациента, хотя на эхокардиограмме наблюдается стабильное повреждение миокарда, вызванное амилоидозом.
Таким образом, поражение сердца вызывают не только амилоидные фибриллы. Считается, что могут повредить миокард до образования амилоидных фибрилл легкие цепи иммуноглобулина. Они могут быть кардиотоксичными. Недавние исследования клеточной токсичности амилоидогенных легких цепей не противоречат этой гипотезе.
Улучшение функции органов, особенно сердечной, было связано с более длительной выживаемостью у пациентов . Эта связь также обнаруживается у пациентов с тяжелой дисфункцией миокарда (примерно 20% всех пациентов). Цель лечения – устранение или уменьшение (<40 мг / л) амилоидогенных легких цепей иммуноглобулина из плазмы, минимизация риска связанной с лечением токсичности и улучшение функции жизненно важных органов.
Если легкие цепи больше не обнаруживаются, реакция организма на лечение считается достигнутой. Между тем, снижение концентраций легких цепей <40 мг / л во время лечения считается достижением очень хорошего частичного ответа на лечение (LGDA), говорящем о том, что реакция организма на лечение достигнута.
Лечение высокими дозами мелфалана с последующей трансплантацией аутологичных стволовых клеток (ACL) обеспечивает гематологическую ремиссию примерно у 40% пациентов. Если это лечение эффективно, наблюдается улучшение функции сердца и, таким образом, увеличивается выживаемость пациентов. Однако такое лечение доступно только тщательно отобранным пациентам с низким уровнем риска (примерно 20% всех пациентов на момент постановки диагноза) и должно проводиться только в специализированных центрах с уровнем смертности <10% из-за осложнений лечения.
AKLT также можно назначать пациентам с TIFN, но у последних выше летальность.
Если ACL исключена, показана химиотерапия с использованием алкилирующих агентов (мелфалан, циклофосфамид), а также стероидов (дексаметазон), ингибиторов протеасом (бортезомиб, иксазомиб и карфилзомиб) и иммуномодулирующих агентов (талидомид, леналомид, леналомомид, леналомидомид). Лечение мелфаланом перорально и высокими дозами дексаметазона (режим Mdex) приводит как минимум к 45% LGDA. У 36 % пациентов улучшается функция органов, а общая выживаемость увеличивается более чем на 7 лет.
Ингибиторы протеосом, такие как бортезомиб, вызывают быстрый гематологический ответ, поскольку плазматические клетки, секретирующие амилоидогенные легкие цепи, богаты протеасомами. Лечение бортезомибом также можно назначать как до, так и после приема АПФ. Совместное применение бортезомиба с Mdex (режим BMDex) приводит к LGDA как минимум у 65% пациентов, а 5-летняя выживаемость пациентов с умеренным риском становится > 80%.
Относительно хорошие результаты лечения были получены в двух небольших клинических испытаниях, в которых субъектов лечили циклофосфамидом, бортезомибом и дексаметазоном (CyBorDсхема). В большой выборке клинических испытаний, LGDA была достигнута по крайней мере у <45% пациентов. Бортезомиб обладает нейротоксическим действием и поэтому не рекомендуется для лечения пациентов с периферической невропатией.
Эффекты перорального ингибитора протеасом нового поколения иксазомиба в лечении рефрактерного / рецидивирующего амилоидоза в настоящее время ещё изучаются. Ожидаются также результаты клинических испытаний карфилзомиба, другого ингибитора протеасом нового поколения, который необратимо ингибирует протеасомы. Карфилзомиб менее нейротоксичен. В последнее время повысилась пригодность этого препарата для лечения сердечного амилоидоза, поскольку карфилзомиб обладает кардиотоксическим действием.
Гематологический ответ можно ожидать, когда иммуномодулирующие лекарственные средства вводятся пациентам, которые не прошли курс лечения алкилирующими агентами или бортезомибом. Эти препараты являются препаратами второго ряда для лечения амилоидоза AL. В иммуномодулирующих лекарственных средствах трудно контролировать сердечный ответ на терапию биомаркерами, поскольку было замечено, что во время такого лечения признаки поражения сердца усиливаются из-за действия самого препарата.
Ученые говорят, что даже если лекарство эффективно и отслеживается гематологическая реакция организма, мы не можем быть уверены, что произойдет серьезная недостаточность жизненно важных органов, что может потребовать прекращения AL-амилоидоза. В этом случае следует рассмотреть возможность трансплантации поврежденного органа (сердца, почки или печени).
При наличии активного заболевания до или после трансплантации следует проводить агрессивное лечение, направленное против патологического клона клетки, такое как AKLT (в случае трансплантации почки). Целью такого лечения является защита трансплантата от повреждения, вызванного амилоидозом. Некоторым пациентам с амилоидозом AL и TIFN может быть трансплантирована почка от живого донора с последующей AKLT.
Перспективы дальнейшего лечения
Доказано, что при лечении миеломы моноклональные антитела против антигена CD38 плазматических клеток (даратумумаб) и антигена SLAMF7 (элотузумаб) эффективны, даже если при лечении первой линии не наблюдается никаких эффектов. Начато новое клиническое исследование даратумумаба у пациентов с амилоидозом AL. Некоторые другие препараты для лечения множественной миеломы также могут быть эффективны у пациентов с амилоидозом AL.
Предложен новый метод пассивной иммунотерапии, способствующий реабсорбции амилоида и восстановлению функции органов. Ученые отметили, что мышиное моноклональное антитело 2A4 способно связываться с агрегатами амилоида AL человека (как каппа-, так и лямбда-цепями) и растворимыми амилоидогенными легкими цепями, но не взаимодействует с нормальными легкими цепями. У мышей 2A4 индуцирует фагоцитоз амилоида AL. Эффект модифицированной версии этого антитела при лечении пациентов с амилоидозом AL исследуется.
Также изучаются другие антитела против структур, участвующих в патогенезе амилоидоза AL, и вещества, способные вмешиваться в экспрессию амилоидогенных белков. Кроме того, были обнаружены маломассовые молекулы, ингибирующие секрецию и адгезию амилоидогенных легких цепей иммуноглобулинов.
Продолжение статьи
- Часть 1. Системный AL амилоидоз.
- Часть 2. Амилоидоз АА – современное лечение.
- Часть 3. АТТR амилоидоз – перспективы лечения.



Для отправки комментария необходимо войти на сайт.