TTR – это белок-носитель в сыворотке крови, который отвечает за транспортировку витамина А и небольшого количества тироксина в организме. Сам по себе TTR является потенциально амилоидогенным белком, который может откладываться в тканях в виде амилоида. TTR дикого типа может повредить миокард у мужчин старше 60 лет и вызвать так называемую транстиретиноамилоидную кардиомиопатию дикого типа (англ. Транстиретин-амилоидная кардиомиопатия дикого типа -ATTRwt).
Содержание статьи
Мутации в TTR
TTR существует в тетрамерной пространственной структуре, но когда он расщепляется на димеры, а затем на мономеры, может произойти ошибка расщепления, и полученные мономеры слипаются вместе, образуя неправильные фибриллы.
Было идентифицировано более 110 мутаций в гене TTR, которые могут увеличивать амилоидогенность белка TTR, и, таким образом, также существует аутосомно-доминантно наследуемый амилоидоз (ATTRm). Заболевание обычно поражает периферическую / вегетативную нервную систему и / или сердце. Амилоидотическая нейропатия и кардиомиопатия обычно прогрессируют, и пациенты умирают в течение 10 лет после появления симптомов.
С почечной недостаточностью при амилоидозе ATTR были связаны несколько генных мутаций. Этот тип заболевания приводит к протеинурии, очень низкому уровню эритропоэтина, тяжелой анемии и прогрессирующей почечной недостаточности и сам по себе обладает амилоидогенными свойствами.
Современное лечение и перспективы лечения
Поскольку основное место производства белка TTR — печень, для лечения ATTRm используется трансплантация печени (хирургическая генная терапия). Наилучшие результаты этой процедуры достигаются при лечении молодых пациентов с вариантом болезни Val30Met (p.Val60Met) и когда болезнь еще не запущена. Но даже после трансплантации печени амилоидогенез может прогрессировать, поскольку белок TTR дикого типа способен в дальнейшем образовывать амилоидные фибриллы и накапливаться в органах-мишенях.
Поскольку эти ситуации очень сложны и многогранны, иногда необходимо выполнить сложные операции с трансплантацией печени и сердца или трансплантацией печени и почек. После трансплантации печени продукция TTR все еще сохраняется в сосудистом сплетении и пигментном эпителии
В настоящее время разрабатываются новые препараты, основанные на биохимических научных знаниях об ASO и siRNA. SiRNA (короткая интерферирующая – РНК) представляет собой короткую цепочку РНК, которая мешает процессу экспрессии белка и препятствует выработке определенного белка.
Препарат на основе SiRNA был протестирован в двух клинических испытаниях фазы I при амилоидозе ATTRm на здоровых добровольцах. Разовая инъекционная доза препарата была безопасной, хорошо переносимой, не вызывала побочных иммунологических реакций и была эффективной в снижении концентрации в сыворотке как мутированного, так и дикого белка TTR. Действие препарата дозозависимо. Сообщалось, что проходят клинические испытания III фазы этого препарата.
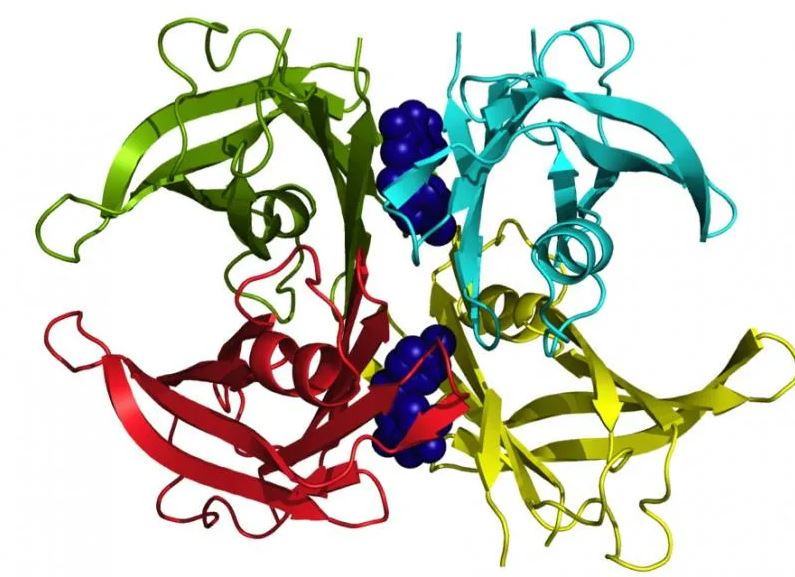
ASO (антисмысловые олигонуклеотиды) представляют собой синтетические полимеры, способные прикрепляться к определенному участку в ДНК или РНК и блокировать экспрессию этого гена. Вообще говоря, эти олигонуклеотиды отключают определенный ген. Проводится клиническое испытание фазы III для оценки эффекта ASO против мРНК TTR при лечении амилоидоза ATTR.
В патогенезе амилоидоза TTR играет важную роль процесс расщепления TTR на мелкие мономеры, побуждая ученых разработать небольшие молекулы, способные связываться с тетрамером TTR и стабилизировать его. Тафамид – единственный такой препарат, одобренный для лечения амилоидоза TTR. Несколько плацебо-контролируемых и неконтролируемых исследований показали, что тафамид безопасен и способен стабилизировать течение амилоидотической полинейропатии и кардиомиопатии у большинства пациентов.
Ученые дали старт международному двойному слепому рандомизированному плацебо-контролируемому клиническому исследованию для оценки безопасности и эффективности тафамида у пациентов с амилоидозом ATTRm и ATTRwt.
Дифлунисал, нестероидный противовоспалительный препарат старого поколения, также способен стабилизировать тетрамер TTR. В рандомизированном плацебо-контролируемом исследовании было показано, что дифлунизал эффективен в замедлении прогрессирования неврологических повреждений и улучшении качества жизни пациентов.
Недавно был обнаружен ещё один перспективный препарат. Талькапон, пероральный препарат для лечения болезни Паркинсона, способен связываться с тетрамером TTR и стабилизировать его. Следовательно, этот препарат может быть одобрен для лечения амилоидоза ATTR в будущем.
Поскольку талькапон обладает способностью преодолевать гематоэнцефалический барьер, он может быть успешно использован для лечения пациентов с амилоидозом ATTR, у которых диагностирована генетическая мутация и вызванные амилоидозом поражения в области лептоменинга. Варианты использования этого препарата все еще исследуются.
Общие рекомендации по лечению амилоидоза
Различные формы амилоидоза лечат по-разному, но также изучаются некоторые общие способы борьбы с этим заболеванием. В лечении системного амилоидоза все большее значение приобретают небольшие молекулы, способные нарушить каскад образования амилоида. Эти препараты включают определенные химиотерапевтические средства и даже антибиотики. В настоящее время для оценки эффектов этих веществ при лечении различных форм амилоидоза проводятся клинические испытания.
Было замечено, что антиоксидант EGCG, содержащийся в зеленом чае, способен ингибировать процесс амилоидогенеза. Эффекты EGCG у пациентов с амилоидозом AL и ATTR изучаются. Уже есть доказательства того, что употребление большого количества зеленого чая у пациентов с амилоидозом AL уменьшает симптомы, связанные с сердечной дисфункцией.
При всех формах амилоидоза в организме обнаруживается сывороточный амилоид P (SAP), который не позволяет макрофагам фагоцитировать патологический амилоидный белок. Поэтому проводятся различные исследования по изучению SAP как мишени для лечения амилоидоза. Предпринимаются попытки открыть методы, ускоряющие выведение SAP из организма, или разработать моноклональные антитела против SAP. Можно ожидать, что результаты этих исследований будут применены в клинической практике в ближайшем будущем.
Вероятно, что универсальные стратегии лечения амилоидоза внесут значительный вклад в улучшение результатов лечения в будущем. Кроме того, такое лечение может улучшить прогноз пациентов с теми формами амилоидоза, для которых не разработано этиологическое лечение, такое как AapoA-I, ALECT2 и т.п.
Выводы
Достижения в лечении множественной миеломы и хронических воспалительных заболеваний также открыли новые возможности для пациентов с амилоидозом AL и AA типов. Развивающаяся фармацевтическая промышленность, модернизация стратегий разработки новых лекарств, углубление знаний о генетической информации и лучшее понимание иммунологических процессов позволили ученым разработать инновационные и многообещающие методы лечения.
Кроме того, при лечении амилоидоза наблюдались положительные эффекты старых, проверенных временем и безопасных лекарств, применяемых для лечения других заболеваний.
Для разработки новых и эффективных лекарств, которые могут воздействовать на эти сложные заболевания, особенно важно понимать потенциальные мишени, что возможно только при хорошем понимании молекулярных механизмов патогенеза заболевания. Для улучшения прогноза и качества жизни пациентов с различными формами амилоидоза важно разработать надежные лабораторные модели и искать новые варианты лечения.
Появление новых лекарств в клинической практике во многом зависит не только от теоретических моделей, но и от способности проводить качественные клинические испытания. Для достижения этой цели важно сотрудничество между различными исследовательскими центрами и активное участие практикующих врачей, ассоциаций пациентов, фармацевтических компаний и государственных органов. Также открывает новые возможности для изучения эффектов фармакологических агентов при лечении амилоидоза использование биомаркеров.
Несмотря на то, что в лечении системного амилоидоза произошел прорыв, полноценной терапии этого заболевания, которая восстанавливает функцию органов, поврежденных в результате амилоидоза, до сих пор не существует. Лучшие результаты достигаются на очень ранней стадии лечения. Поэтому важно привлечь внимание общественности к этой редкой, коварной, сложной и не всегда поддающейся диагностике болезни.
Продолжение статьи
- Часть 1. Системный AL амилоидоз.
- Часть 2. Амилоидоз АА – современное лечение.
- Часть 3. АТТR амилоидоз – перспективы лечения.



Для отправки комментария необходимо войти на сайт.